
5月16日下午,周口市中心医院消化内科首个药物临床试验项目“评价 TQA2225/AP025 在成人非酒精性脂肪性肝炎(NASH)受试者中的有效性和安全性的Ⅱ期随机、双盲、安慰剂对照研究”启动会在人民路院区召开。我院消化内科一病区主任赵明、申办者代表、科室研究人员和机构办成员参加会议。启动会由机构办主任刘阳主持。

非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤,包括非酒精性肝脂肪变、非酒精性脂肪性肝炎(NASH)、肝硬化和肝细胞癌。目前,NAFLD 全球患病率约 25%,已为主要慢性肝病之一。脂肪肝(肝脂肪变性)在中国非常普遍,少数 NAFLD 患者发展为肝硬化(4~8%)或肝细胞癌(1~5%)。
在过去十年中,随着肥胖人群的不断增加,NAFLD 患病率已增加约一倍,但公众对该疾病的了解仍非常有限,对 NASH 的干预措施也很局限,全球尚无批准治疗 NASH 的药物。
本研究采用随机、双盲、安慰剂对照、剂量递增的试验设计,评估 TQA2225/AP025 在非酒精性脂肪性肝炎患者中有效性、安全性、耐受性及免疫原性,前期研究结果提示该药用药安全、耐受性较好,已有研究结果支持 TQA2225/AP025 继续临床开发。
项目介绍

研究者:消化内科一病区主任 赵明
项目名称:评价 TQA2225/AP025 在成人非酒精性脂性肝炎(NASH)受试者中的有效性和安全性的Ⅱ期随机、双盲、安慰剂对照研究(方案编号TQA2225-II-01)。
主要研究目的:
评价 TQA2225/AP025 在非酒精性脂肪性肝炎受试者中的有效性。
次要研究目的:
评价 TQA2225/AP025 在非酒精性脂肪性肝炎受试者中的安全性;
评价 TQA2225/AP025 在非酒精性脂肪性肝炎受试者中的免疫原性;
评价 TQA2225/AP025 在非酒精性脂肪性肝炎受试者中的药代动力学(PK)特征。
参加本试验的患者需满足以下要求:
1) 试验前签署知情同意书,并对试验内容、过程及可能出现的不良反应充分了解;
2) 能够按照试验方案要求完成试验;
3) 受试者(包括伴侣)自筛选至最后一次接受试验用药品后 6 个月内自愿采取有效避孕措施;
4) 签署知情同意时,18 岁≤年龄≤75 岁,男女性别不限;
5) 经研究者或有资质的病理医生确认后,根据美国 NASH 临床研究网络评分系统(NASH-CRN),肝活检结果符合以下标准(接受筛选前 6 个月内进行的肝脏活检结果):
▪ NAS 评分≥4 分,其中炎症和气球样变各至少 1 分;
▪ 同时, F1≤CRN 纤维化≤ F3。
本试验受试者入组标准以肝活检结果为主要评价标准,若受试者符合此条入选标准,需完善入选标准第 6、7 条的检查,但对检查结果不做要求。
6) 若筛选前 6 个月内无可用肝活检结果,需在筛选期进行肝脏活检。在筛选期肝活检前,一般需依次符合以下要求,再进行肝活检:
①. 筛选时需满足血清 ALT≥1 倍的正常值上限(ULN);
②. 通过 Fibroscan 证实 LSM≥ 7.3 kpa;
③. MRI-PDFF 证实肝脏脂肪含量≥10%。
若根据研究者的经验判断受试者极可能符合入选标准 5,则可根据实际情况调整检查顺序,或先行进行肝活检检查。
7) 在筛选之前至少 6 周保持体重稳定,体重稳定定义为体重增加或减少≤5%。注:对于在筛选期之前进行基线肝脏活检的受试者,则在肝活检后至筛选期必须保持体重稳定。所有受试者在筛选期至基线时仍需保持体重稳定。
8) 不饮酒或无过量饮酒史。过量饮酒史定义为:过去 12 个月每周饮用乙醇( 酒精) 男性≥210 g,女性 ≥ 140g。乙醇摄入量( g) = 饮酒量( ml) × 酒精度数% × 0.8 。
以下图片/表格二选一
周口市中心医院在研临床试验项目一览表
(GCP项目)
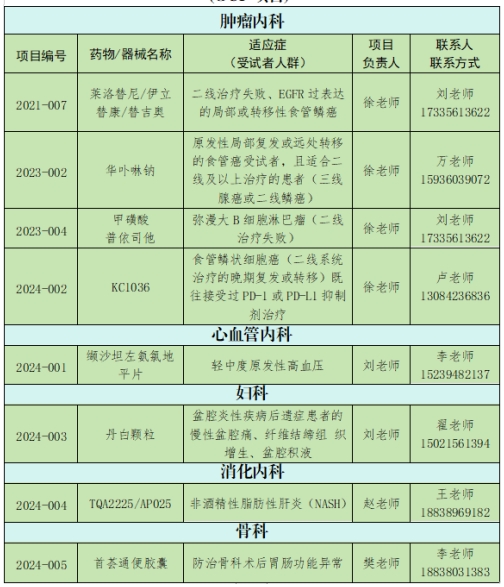
周口市中心医院在研临床试验项目一览表
(GCP项目)
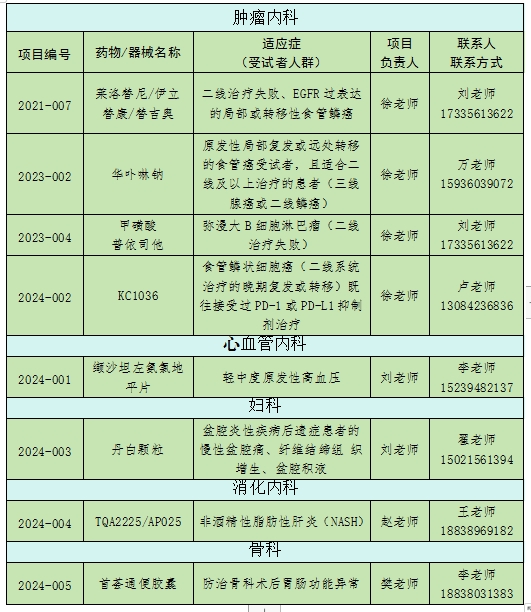
作者/GCP机构办 刘辉

人民路院区:河南省周口市川汇区人民路东段26号
文昌路院区:河南省周口市文昌路与峨嵋山路交叉口
患者咨询:0394-96669 门诊热线:0394-8269105
急诊中心:0394-8269120
新生儿接诊电话:0394-8520878